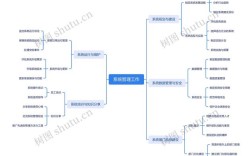
高中化学有机化学思维导图
中心主题:有机化学
核心思想: 结构 → 性质 → 用途
有机物的结构与分类
有机物的主要特点
- 元素组成: 主要由 C、H、O、N、S、P 等元素组成,核心是碳。
- 结构特点:
- 碳原子间易形成共价键(单键、双键、三键)。
- 易形成碳链和碳环。
- 同分异构现象普遍。
- 性质特点:
- 多数难溶于水,易溶于有机溶剂。
- 多数受热易分解,易燃烧,大多产生黑烟(因含碳量高)。
- 反应复杂、速度慢,常需要加热或催化剂。
- 同分异构体普遍存在。
有机物的分类
- 按碳骨架分:
- 链状化合物: 如烷烃、烯烃、炔烃。
- 环状化合物:
- 脂环化合物: 如环己烷。
- 芳香族化合物: 含苯环,如苯、甲苯。
- 按官能团分: (这是最重要的分类方式)
- 烃类:
- 烷烃 (官能团:无)
- 烯烃 (官能团:C=C)
- 炔烃 (官能团:C≡C)
- 芳香烃 (官能团:苯环)
- 烃的衍生物:
- 卤代烃 (官能团:-X, X=F, Cl, Br, I)
- 醇 (官能团:-OH)
- 酚 (官能团:-OH,直接连在苯环上)
- 醛 (官能团:-CHO)
- 酮 (官能团:C=O)
- 羧酸 (官能团:-COOH)
- 酯 (官能团:-COO-)
- 含氮化合物:如胺 (-NH₂)、酰胺 (-CONH₂)
- 烃类:
代表性有机物的结构与性质
烃
- 烷烃 (如甲烷 CH₄)
- 结构: 单键,链状或环状,饱和烃。
- 性质:
- 氧化: 难被氧化,不能使酸性高锰酸钾褪色。
- 取代: 光照下与卤素发生取代反应 (特征反应)。
- 燃烧: 火焰呈淡蓝色,生成 CO₂ 和 H₂O。
- 代表物: 甲烷 (CH₄)、乙烷 (C₂H₆)、乙烯 (C₂H₄)...
- 烯烃 (如乙烯 C₂H₄)
- 结构: 含 C=C 双键,不饱和烃。
- 性质:
- 氧化: 能被酸性高锰酸钾氧化,使酸性 KMnO₄ 褪色。
- 加成: 与 H₂、X₂、H₂O、HX 等发生加成反应 (特征反应)。
- 聚合: 发生加聚反应,形成高分子。
- 代表物: 乙烯 (C₂H₄)、丙烯 (C₃H₆)
- 炔烃 (如乙炔 C₂H₂)
- 结构: 含 C≡C 三键,不饱和烃。
- 性质:
- 氧化: 能被酸性高锰酸钾氧化,使酸性 KMnO₄ 褪色。
- 加成: 与 H₂、X₂、H₂O、HX 等发生加成反应。
- 燃烧: 火焰明亮,伴有浓烈黑烟。
- 代表物: 乙炔 (C₂H₂)
- 芳香烃 (如苯 C₆H₆)
- 结构: 平面正六边形结构,碳碳键介于单双键之间。
- 性质:
- 取代: 发生卤代、硝化、磺化等取代反应 (特征反应)。
- 加成: 特殊条件下,可与 H₂ 发生加成反应。
- 氧化: 不能被酸性高锰酸钾氧化,苯环稳定。
- 代表物: 苯 (C₆H₆)、甲苯 (C₇H₈)
烃的衍生物
- 卤代烃 (如溴乙烷 C₂H₅Br)
- 官能团: -Br
- 性质:
- 水解反应: 在 NaOH 水溶液中加热,生成醇。
- 消去反应: 在 NaOH 醇溶液中加热,生成烯烃 (条件:强碱、醇、加热)。
- 醇 (如乙醇 C₂H₅OH)
- 官能团: -OH (羟基)
- 性质:
- 与 Na 反应: 产生 H₂ (活泼性:Na > H₂O > 醇)。
- 氧化反应:
- 燃烧。
- 催化氧化成醛 (Cu 或 Ag 作催化剂)。
- 被酸性高锰酸钾或重铬酸钾氧化。
- 消去反应: 生成烯烃 (条件:浓硫酸、170℃)。
- 酯化反应: 与羧酸反应生成酯。
- 酚 (如苯酚 C₆H₅OH)
- 官能团: -OH (直接连在苯环上)
- 性质:
- 弱酸性: 与 NaOH 反应,但与 NaHCO₃ 不反应。
- 取代反应: 与浓溴水反应生成三溴苯酚 (白色沉淀,用于检验)。
- 显色反应: 与 FeCl₃ 溶液反应显紫色 (用于检验)。
- 氧化反应: 在空气中易被氧化而变色。
- 醛 (如乙醛 CH₃CHO)
- 官能团: -CHO (醛基)
- 性质:
- 氧化反应:
- 银镜反应 (与银氨溶液)。
- 与新制 Cu(OH)₂ 反应 (生成砖红色沉淀)。
- 被氧气氧化成羧酸。
- 还原反应: 加氢还原成醇。
- 氧化反应:
- 羧酸 (如乙酸 CH₃COOH)
- 官能团: -COOH (羧基)
- 性质:
- 酸性: 具有酸的通性,比碳酸酸性强。
- 酯化反应: 与醇在浓硫酸催化下加热,生成酯和水。
- 酯 (如乙酸乙酯 CH₃COOC₂H₅)
- 官能团: -COO- (酯基)
- 性质:
- 水解反应: 在酸或碱的催化下发生水解,碱性水解完全 (用于制肥皂)。
有机化学反应类型
- 取代反应: “有进有出” (原子或原子团被替换)。
- 例子: 卤代、硝化、磺化、酯化、水解。
- 加成反应: “只加不减” (不饱和键打开,加上原子或原子团)。
- 例子: 烯烃/炔烃与 H₂、X₂、H₂O、HX 的反应。
- 消去反应: “去小不留” (从一个分子脱去小分子如 H₂O、HX,形成不饱和键)。
- 例子: 醇的消去、卤代烃的消去。
- 氧化反应:
- 有机物中: 加氧或去氢。
- 例子: 燃烧、醇氧化成醛/酮、醛氧化成酸。
- 还原反应:
- 有机物中: 加氢或去氧。
- 例子: 烯烃/炔烃/醛加氢。
- 聚合反应:
- 加聚反应: 不饱和小分子通过加成反应聚合成高分子。
- 例子: 乙烯聚合成聚乙烯。
- 缩聚反应: 单体间通过缩去小分子(如 H₂O)聚合成高分子。
- 例子: 酸和醇生成酯、氨基酸生成蛋白质。
- 加聚反应: 不饱和小分子通过加成反应聚合成高分子。
有机物的检验与分离
检验
- 烷烃: 不能使酸性 KMnO₄ 褪色。
- 烯烃/炔烃: 使酸性 KMnO₄ 褪色;使溴水褪色。
- 苯的同系物: 使酸性 KMnO₄ 褪色。
- 苯: 不能使酸性 KMnO₄ 褪色;不能使溴水褪色(萃取)。
- 卤代烃: 在 NaOH 水溶液中加热后,加 HNO₃ 酸化,再加 AgNO₃,根据沉淀颜色判断卤素原子。
- 醇: 与 Na 反应产生 H₂。
- 酚:
- 与浓溴水反应生成白色沉淀。
- 与 FeCl₃ 溶液反应显紫色。
- 醛:
- 银镜反应 (产生光亮的银镜)。
- 与新制 Cu(OH)₂ 反应生成砖红色沉淀。
- 羧酸: 使紫色石蕊试液变红。
- 酯: 有果香味。
分离与提纯
- 方法: 萃取、分液、蒸馏、洗气。
- 原则: 不增、不减、易分、复原。
- 常见操作:
- 分液: 互不相溶的液体 (如水和有机物)。
- 蒸馏: 沸点不同的液体混合物 (如乙醇和水)。
- 洗气: 气体混合物 (如除去甲烷中的乙烯)。
有机高分子化合物
- 概念: 由相对分子质量很大的化合物构成的物质。
- 分类:
- 天然高分子: 淀粉、纤维素、蛋白质、天然橡胶。
- 合成高分子: 塑料、合成纤维、合成橡胶。
- 三大合成材料:
- 塑料: 聚乙烯、聚氯乙烯。
- 合成纤维: 涤纶、锦纶、腈纶。
- 合成橡胶: 丁苯橡胶、顺丁橡胶。
核心思想与应用
- 核心思想贯穿始终:
- 官能团决定化学性质: 抓住官能团,就能掌握一类物质的性质。
- 同分异构体: 分子式相同,结构不同,判断同分异构体是重点和难点。
- 有机合成路线设计: 以目标产物为导向,逆向推导,利用官能团的转化关系。
- 与生活联系:
- 能源: 天然气、石油、液化气。
- 材料: 塑料、纤维、橡胶、药物、染料。
- 生命基础: 糖类、油脂、蛋白质、核酸。
学习建议
- 抓主线: 以“官能团”为线索,串联各类物质的性质和反应。
- 多对比: 对比不同类别物质(如醇和酚、醛和酮、烷烃和烯烃)的异同点。
- 记特例: 记住苯、甲苯、苯酚、乙醛等代表物的特殊性质。
- 练书写: 熟练书写化学方程式,特别是反应条件和反应类型。
- 建网络: 在脑海中构建这张思维导图,形成知识体系。
希望这份思维导图能帮助你更好地学习高中有机化学!